|
[2.1] 酵母菌に対する圧力効果
数百MPaの高圧力は微生物を死滅させるので、このことを利用し我が国では超高圧で殺菌や加工した食品が流通しています。また、卵や牛乳などに含まれるアレルゲンタンパク質を圧力で低アレルゲン化するといったユニークなアイディアも提案されています。出芽酵母S. cerevisiaeの場合、おおむね150 MPa以上の高圧で生存率が0.05%以下に低下します。この条件では微小管やアクチンフィラメントの形態に異常が見られ、200 MPaでは核膜が損傷し倍数体も出現してきます。分裂酵母Schizosaccharomyces pombeはS. cerevisiaeよりも圧力に対して弱いことが知られています。
[2.2] トリプトファン輸送と酵母の高圧増殖
10〜50 MPaなら24時間培養しても酵母の生存率にはほとんど影響ありません。しかし増殖速度は著しく低下します。増殖という点で圧力感受性が最も高いのはトリプトファンの取り込みでした。4種類のアミノ酸、トリプトファン、ロイシン、リジン、ヒスチジン、ならびにアデニンとウラシルを栄養要求性マーカーとする野生型YPH499株(trp1 leu2 lys2 his3 ade2 ura3)があります。この菌株を15〜25MPaで培養すると細胞周期がG1期で停止することがわかりました。ところが、TRP1やトリプトファン輸送体遺伝子TAT1、TAT2を高発現させたり、培地にトリプトファンを過剰量添加するとG1期停止せず、細胞は高圧下で増殖するようになります。しかし、他の栄養要求性の相補遺伝子をまとめて導入しても細胞は決して高圧下で増殖することはありません。ここで、TAT1とTAT2はそれぞれ低親和性と高親和性のトリプトファン輸送体遺伝子で、もともと免疫抑制剤FK506への耐性遺伝子としてクローニングされました。出芽酵母ゲノムにはこうしたアミノ酸輸送体の遺伝子がホモログとあわせ24個コードされており、それら12回膜貫通型と予測されています。加圧によるG1期停止の原因は、トリプトファンの欠乏でタンパク質合成速度が低下し、ターンオーバーの速いG1サイクリンが速やかに消失した結果と言えます。TAT2高発現株は高圧下だけではなく10℃以下の低温でも良く増殖します。高圧と低温、あたかも深海環境のような条件ですが、トリプトファンの取り込みさえ十分に行えれば両条件下で増殖可能というあたりが“コロンブスの卵”的でおもしろいといえます。どうやら適正な生体膜の状態というのが大事で、それが失われたとき直ちに悪影響を被るのがトリプトファンの取り込みらしいのです。実際、アミノ酸要求性を持たない実用酵母は高圧や低温条件でもゆっくりとですが増殖します。最近の研究から、酵母のトリプトファン取り込みは“細胞のアキレス腱”と呼ばれるほど様々なストレスに弱いことがわかってきました。そうしたストレス要因でトリプトファン要求性株の増殖は止まり、多くの場合、TAT2高発現により耐性となります。この現象の背後にあるのが次に登場するユビキチンシステムです。ところで我々人間を含め動物は、トリプトファンを合成できないので外から摂取しなくてはなりません。トリプトファンはヒトの脳内ホルモンセロトニンの合成材料ですし、植物ではオーキシン(インドール酢酸)の前駆体として知られています。いずれも超微量で効果的な細胞間伝達物質です。
|
 |
[2.3] 高圧増殖変異とユビキチンシステム
私たちは高圧増殖変異HPG(High-pressure growth)株を単離し解析する過程で、野生株を高圧培養するとユビキチン依存的にトリプトファン輸送体Tat2の分解が促進されること、そしてこのシステムに失陥があるとTat2が安定化し細胞は高圧下で増殖することなどを示してきました。ユビキチンシステムは真核生物における細胞内タンパク質の選択的分解機構で、高度に保存された76アミノ酸からなるユビキチン分子が主役です。E1-E2-E3という一連の酵素タンパク質群を経てユビキチンがターゲットに結合すると、そのタンパク質はやがて細胞内のプロテアソームや液胞に運ばれ分解されます。HPG1はE3であるHECT型ユビキチンリガーゼRsp5の準優性変異です。HPG1株ではTat2のユビキチン化が進まず、細胞膜上に蓄積します(図2)。これはちょうど前述したTAT2の高発現に近い状態のため高圧下で増殖するわけです。一方、高圧増殖変異HPG2の変異部位はTat2そのものに見つかりました。Tat2タンパク質ではN末端から29番目または31番目のリジンがユビキチン化されることが既にわかっていました。HPG2-1 (Tat2Glu27>Phe) は、その近傍のExKSモチーフ内部に見つかりました。ExKS(Glu-x-Lys-Ser)配列はαファクター受容体Ste2に代表される膜タンパク質のユビキチン化とエンドサイトーシスに必須なSINDAKSSモチーフのコア配列 (DAKS) に類似しています。一方、HPG2-2 (Tat2Asp563>Asn) とHPG2-3 (Tat2Glu570>Lys) はC末端の変異で、それらはKQEIAE配列の内部と近傍に見つかりました。KQEIAE配列は総アミノ酸輸送体Gap1にも存在し、ここにアミノ酸置換が入るとGap1のユビキチン化やエンドサートーシスが起こらなくなります。結果としてHPG2株のTat2(Hpg2と呼んでもいい)は野生型に比べて細胞膜に圧倒的に多く局在し、やはりユビキチン化をまぬがれるため細胞は高圧下で増殖します。
[2.4] DNAシャッフリングとエラープローンPCRを用いたトリプトファン輸送体Tat1/Tat2の機能解析
現在私たちは、DNAシャッフリングを用いた輸送体タンパク質キメラの作製、およびエラープローンPCRを用いたランダム変異の導入を行っています。こうした変異型輸送体タンパク質の細胞内局在やユビキチン依存性分解、そしてトリプトファン輸送活性を野生株と比較することで、Tat1やTat2における上記機能に重要なドメインやアミノ酸残基が明らかになるはずです。トリプトファンは希少で重要なアミノ酸です。しかし細胞内輸送の分子機構はどんな生物でもあまりよくわかっていません。酵母をモデルとした私たちの研究が、基礎的知見の蓄積に貢献するのはないかと期待しています。
|
 |
|
 |
[2.5] 脂質ドメインとトリプトファン輸送体の局在
真核生物の細胞膜は流動性に富むグリセロリン脂質の他に、スフィンゴ脂質やコレステロール(酵母の場合はエルゴステロール)を含み、タイトなドメインを形成しています。以下、これを“脂質ドメイン”と呼び、グリセロリン脂質部分と区別します。多くの実験系ではTriton-X100などの非イオン性界面活性剤に不溶性の膜画分(DRMs; detergent resistant membranes)として取り扱われていますが、生きた細胞で本当にドメインを作っているかどうかにはまだ議論の余地があります。酵母の場合、スフィンゴ脂質やエルゴステロールは小胞体→ゴルジ体→細胞膜と輸送される過程で割合が増していきます。
野生株でTat2はグリセロリン脂質に存在します。ところがユビキチンリガーゼが変異したり、N末端にLys→Arg変異が生じるや否やTat2は脂質ドメインに取り込まれ、細胞膜に効率よく運ばれるようになります。一方、H+-ATPase Pma1、ウラシル輸送体Fur4、そしてTat1は野生株でもともと脂質ドメインに存在し、ユビキチンリガーゼが変異しても局在は変化しません。こうした膜貫通領域(TMD; transmembrane domain)の多いタンパク質において、脂質局在を規定する要因は何なのか?なぜTat2ではユビキチン変異−それがリガーゼの変異であってもTat2自体に起きても−局在が変わるのか?これらについては未だ謎に包まれています。
[2.6] トリプトファン輸送の動態
圧力をツールとした解析から、酵母におけるトリプトファンの輸送は非常にダイナミックで輸送体タンパク質に大きな構造変化を伴うことがわかりました。次のような原理に基づいています。図1で示したように、酵素−基質複合体が基底状態(ES)から活性化(遷移)状態(ES≠)に至る際の活性化体積ΔV≠は式 [3] から求められます。活性化体積は、ΔV≠ = ΔV≠interaction + ΔV≠hydration + ΔV≠conformationのように部分モル体積の和で表され、それぞれ酵素−基質の相互作用に伴う体積変化(第1項)、酵素の水和構造の変化に伴う体積変化(第2項)、そして酵素のコンフォメーション変化に伴う体積変化(第3項)です。ここで、Tat1やTat2を酵素E、トリプトファン分子を基質Sとし、遷移状態理論に従ってトリプトファンが細胞内に輸送されるものとみなします。Tat1とTat2はともに同じトリプトファンを輸送するうえ、一次構造の相同性が高いので第1項と第2項には両者間で大きな差はないと考えられます。すると、Tat1とTat2に活性化体積の相違があるとすればほぼ第3項、膜タンパク質と近傍の脂質を含めた構造変化にあります。
|
 |
実測値から、Tat1依存性のΔV≠は89.3 ml/mol、Tat2依存性だと50.8 ml/molといずれも大きな値ですがが、Tat1の方がTat2よりも体積変化が2倍近く大きいことがわかります。タイトな脂質ドメインに局在するTat1の方が流動性の高いグリセロリン脂質にあるTat2よりも大きく構造が変化するというのは意外に思われるかもしれません。しかし、むしろこれは基底状態の体積差で考えると合理的に理解されます。すなわち、輸送する基質分子が同じなので活性化(遷移)状態における体積そのものはほぼ等しい(V≠Tat1= V≠Tat2)。ところが、基底状態ではTat1は脂質ドメインにあるがゆえ体積が小さく(VTat1< VTat2)、差としてはTat1依存の活性化体積の方が大きくなる(ΔV≠Tat1> ΔV≠Tat2)(図3)。脂質ドメイン、グリセロリン脂質に存在する膜タンパク質のダイナミズムに示唆を与えるものです。膜タンパク質全般について高圧下で活性を測定し、これを脂質の構造と関連づけることができれば、脂質環境を反映した膜タンパク質のダイナミズムをΔV≠を指標として探ることができるに違いありません。
|
 |
|
 |
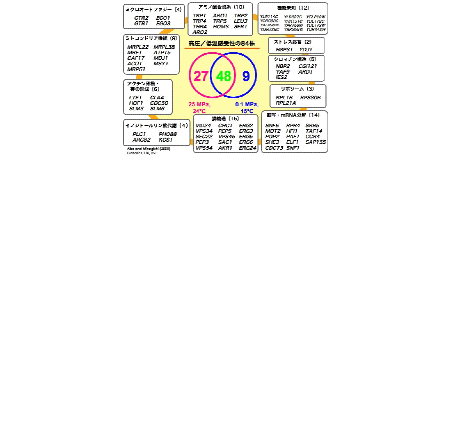
[2.7] ゲノムレベルで見た高圧・低温条件下の増殖に必要な遺伝子
出芽酵母には約6,000個の遺伝子が存在しますが、うち約4,800個は単独破壊しても致死とはなりません。私たちはそれら遺伝子破壊株のライブラリーであるYeast deletionsを高圧・低温下でスクリーニングし、84個の感受性株を取得しました。すなわち少なくとも84個の遺伝子が酵母の高圧・低温増殖に不可欠なのです(図4)。なお用いた親株は自らトリプトファンを合成できるため、高圧(25MPa, 25°C)や低温(0.1MPa, 15°C)で増殖することができます。予想通りトリプトファン合成系に失陥があると、酵母はこうした条件下で増殖できなくなります。また、新たにフェニルアラニンやチロシン、セリン、スレオニンといったアミノ酸の合成系にも重要性が見いだされました。それら破壊株の増殖は培養液中のアミノ酸に依存するので、裏を返すと上記アミノ酸の取り込みが高圧や低温下で阻害されることを意味しています。その他にもミクロオートファジーや膜輸送、ミトコンドリア機能やアクチン骨格の形成、転写やmRNAの分解に関わる因子など多岐にわたり、12個の機能未知遺伝子を含め、実に多用な遺伝子が高圧や低温下の増殖を支えていることがわかりました。
|
 |
|